Nación
Exclusivo: los datos que Invima le pidió a Sinovac sobre el uso de su vacuna en menores de 12 años
El instituto solicitó información que no tiene ningún laboratorio, pero Sinovac respondió en la medida de lo posible. El Gobierno espera que se dé muy pronto la autorización.
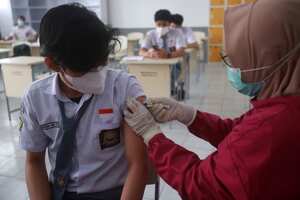
El pasado 8 de octubre, el ministro de Salud, Fernando Ruiz, anunció que los menores de 12 años podrían empezar a recibir la vacuna contra la covid-19, probablemente de Sinovac o Pfizer, en un corto plazo. Desde entonces, el laboratorio chino envió la solicitud al Instituto Nacional de Vigilancia de Medicamentos y Alimentos (Invima) para modificar su autorización de uso de emergencia (ASUE) y poder aplicarla a menores entre 3 y 11 años.
Si bien el Invima revisó la evidencia inicial compartida por el laboratorio para lograr dicha autorización, decidió pedir información adicional a la farmacéutica.
SEMANA conoció en exclusiva el listado de requerimientos que hizo el Invima a Sinovac para dar dicha autorización. Este incluye un aspecto que llama especialmente la atención, debido a que se trata de un dato con el que no cuenta ninguna farmacéutica, ni siquiera para la población adulta: “presentar datos de efectividad clínica del uso de la vacuna en ‘vida real’ (modificación de incidencia de covid-19 confirmado, hospitalización o muerte en el grupo etario de 3 a 17 años); así mismo, datos o análisis del impacto de la vacunación masiva de niños de 3 a 17 años en la trasmisión de la enfermedad en la población”.
Así mismo, el Invima solicitó a Sinovac enviar la información sobre el análisis de vacunación de la población entre 3 y 17 años en China, ya que en ese país se han administrado más de 40 millones de vacunas en el grupo etario entre 3 y 17 años.
Lo más leído
Sumado a eso, Sinovac debió presentarle al Invima los conceptos que emitieron las agencias regulatorias de Chile, Brasil y otras que hayan solicitado la ampliación del grupo etario en el permiso de vacunación.
Por otra parte, el instituto también pidió que la compañía china justificara la solicitud del uso de la vacuna en los menores de 12 años que tienen bajo riesgo de complicaciones a causa de la covid-19. Es decir, Sinovac deberá explicar cuál es su interés en inmunizar a dicho grupo etario, considerando que no existe suficiente conocimiento todavía sobre los efectos adversos con baja frecuencia y/o que podrían aparecer a mediano y largo plazo.
Según le confirmaron fuentes del Invima a SEMANA, dado que Sinovac ya envió la información pertinente en la medida de lo posible, en los próximos días podría haber decisiones al respecto.
Esta población suma más de 4 millones de personas y la aprobación de su inmunización impulsaría en números el Plan Nacional de Vacunación, que necesita subir su ritmo para alcanzar la meta de 35 millones de esquemas iniciados antes de que termine octubre.
El objetivo de fin de año, de alcanzar ese número o el 70 por ciento de la población con esquemas completos antes de que termine el 2021, implica que el ritmo suba a más de 300 mil dosis diarias aplicadas. En caso de habilitarse la vacunación para los más pequeños, las posibilidades aumentarían aún más, pues la población con posibilidad de ser recipiente crecería.
A finales de septiembre, Chile comenzó la inmunización de niños y niñas entre 6 y 12 años con la vacuna china, siendo pionero en la región. Además, Pfizer solicitó a la FDA recientemente la aprobación de su biológico para menores entre 5 y 11 años. Todo lo anterior, ambienta las decisiones del sector en Colombia. No obstante, a pesar de las presiones del Ministerio de Salud, la última palabra la tiene la Sala Especializada del Invima.