SALUD
A propósito del caso de Javier Acosta y su solicitud de eutanasia: ¿por qué no cura el hongo ‘Candida auris’?
Las infecciones por hongos se conocen como la pandemia desconocida. Aquí un escrito de Manuel Peinado Lorca, director del Real Jardín Botánico de la Universidad de Alcalá, y José Miguel Sanz Anquela, profesor honorífico del Departamento de Medicina y Especialidades Médicas.
Hace tres meses, uno de los autores que firman este artículo tomó conciencia de uno de los diagnósticos más temibles que nos pueden comunicar cuando estamos hospitalizados: “Tiene una infección resistente a los antibióticos”. Eso significa que los microorganismos que nos enferman no pueden eliminarse fácilmente con antibióticos comunes, lo que complica el tratamiento.
Aunque solemos asociar la resistencia a antibióticos con las infecciones bacterianas, las cada vez más frecuentes patologías asociadas con hongos que también eluden la acción de los fármacos obligan a familiarizarnos con términos como “antimicótico” o “antifúngico”.
Una seria amenaza para la salud humana
Que los hongos resulten tan vitales para nosotros como los animales y las plantas no ha evitado que hayan sido poco estudiados. Algo insólito teniendo en cuenta que las enfermedades que provocan son responsables de unas tasas letales similares a las de la tuberculosis y más de tres veces superiores a las de la malaria.
Son cifras especialmente notables si se considera lo poco que se sabe sobre la biología de los patógenos fúngicos y la falta de reconocimiento de los efectos de sus infecciones en la salud humana. Esas infecciones están detrás de millones de casos de enfermedades, incluyendo la aspergilosis pulmonar crónica e invasiva, la candidiasis, la histoplasmosis o las neumonías. A estas dolencias hay que sumar millones de pacientes con asma fúngico y otro millón de afectados por queratitis.
Lo más leído
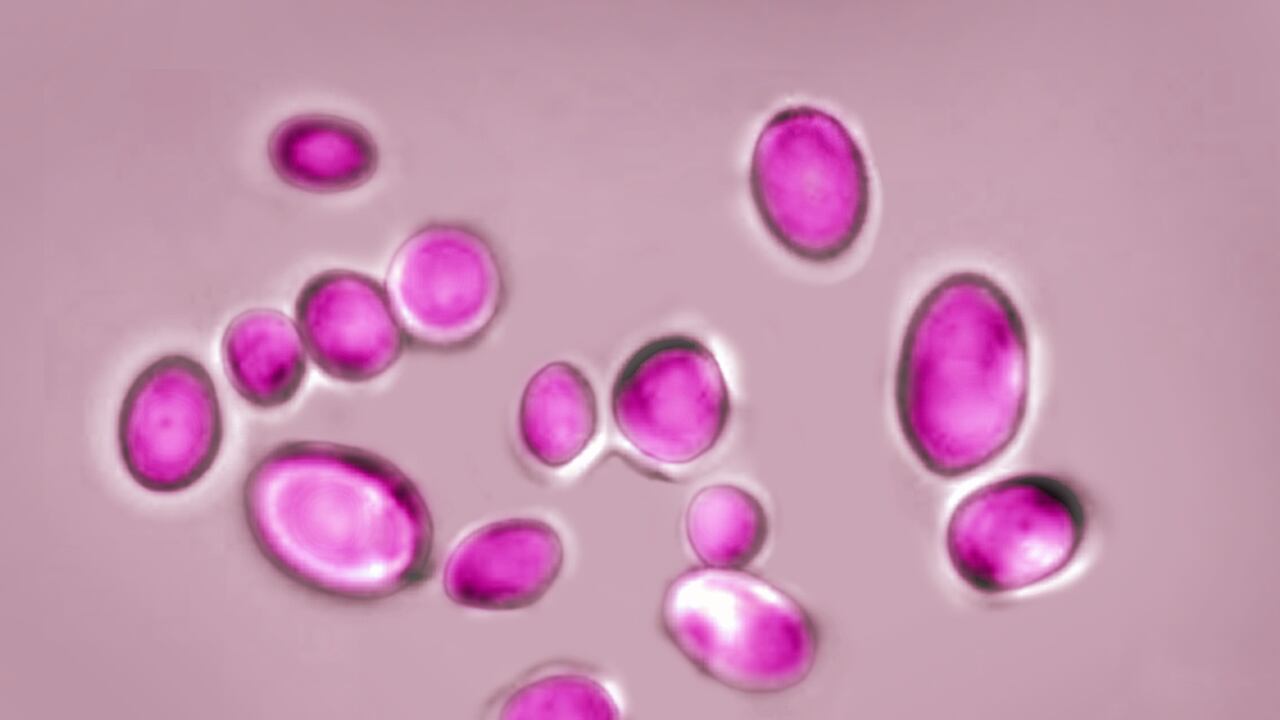
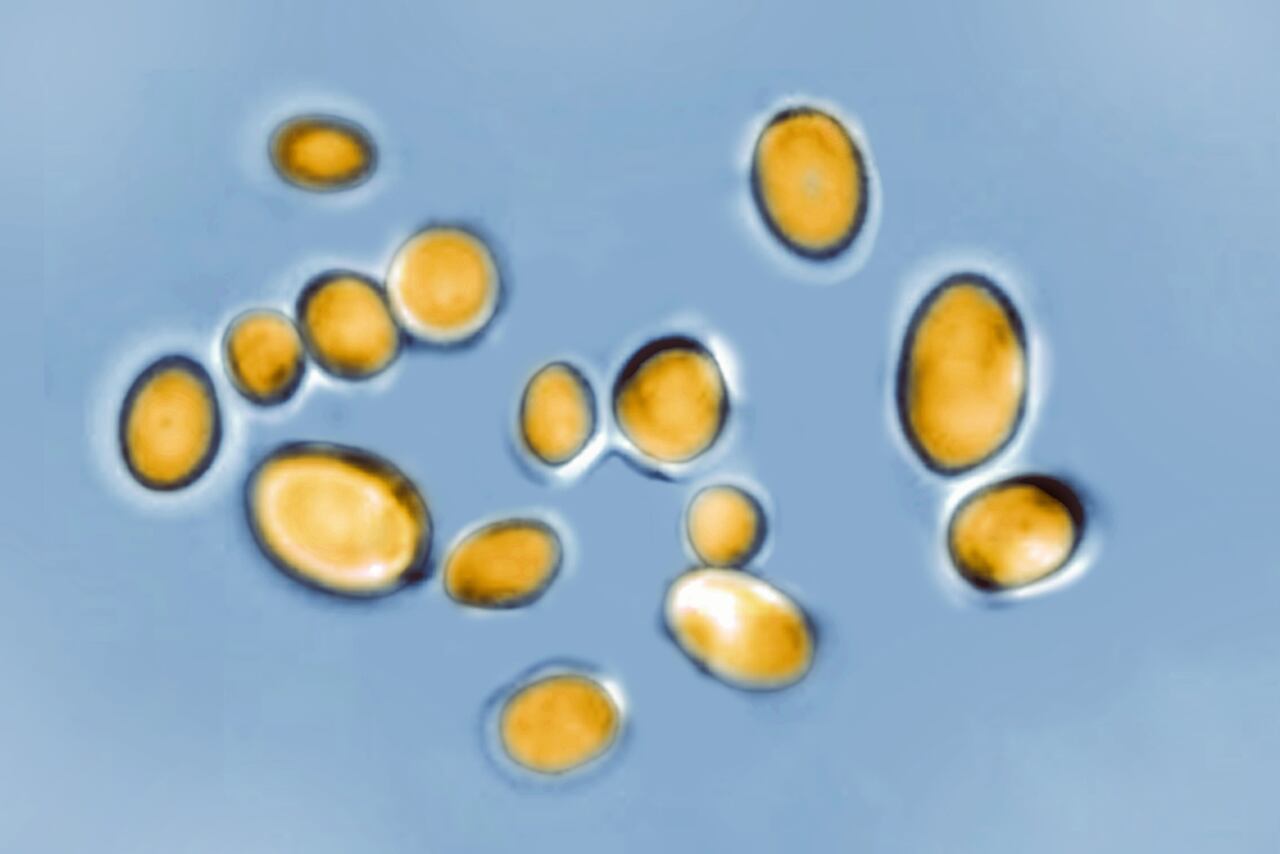
Un reciente informe de la OMS reveló que las infecciones por hongos causan cada año más de 1,5 millones de muertes. El documento identifica diecinueve mohos y levaduras patógenos como las mayores amenazas para la salud humana. Entre los cuatro considerados de peligrosidad crítica destaca la levadura Candida auris, un patógeno emergente capaz de causar infecciones graves potencialmente mortales.
Su apellido, auris, proviene del latín y significa “oído”, ya que fue detectado por primera vez en el conducto auditivo externo de un paciente. Actualmente, se ha convertido en un patógeno nosocomial (que causa infecciones en hospitales) multirresistente a nivel mundial. Está considerado como una gran amenaza en entornos sanitarios.
Fármacos que apuntan a la pared
Pero ¿cómo se volvió tan poderosa C. auris? Para comprenderlo, debemos adentrarnos en la estructura de las células de los hongos. A diferencia de las células animales, a las que rodea una delgada membrana formada por lípidos, las de los hongos están envueltas por una gruesa pared que les brinda forma y protección.
Dicha pared está compuesta por diferentes tipos de polisacáridos, que son cadenas largas de moléculas de azúcar unidas entre sí. Dos polisacáridos presentes en casi todas las paredes celulares de los hongos son la quitina, que forma también parte del esqueleto externo de muchos insectos, y los betaglucanos.
Como las células animales carecen de ella, ese tipo de pared celular es una diana terapéutica de primer orden para los medicamentos: aquellos capaces de bloquear la producción de ambos polisacáridos tendrán menos efectos secundarios una vez aplicados a pacientes humanos.
Algunos de los fármacos más comunes que se usan para tratar infecciones por hongos son las equinocandinas. Estos medicamentos impiden que las células produzcan betaglucanos, lo cual debilita su pared hasta el punto de que no puede mantener bien su forma. Mientras el hongo está luchando por crecer o se está fragmentando, nuestro sistema inmunológico tiene muchas más posibilidades de combatir la infección.
Así sortea ‘C. auris’ los tratamientos
Desgraciadamente, algunas cepas de C. auris son resistentes al tratamiento con equinocandinas. ¿Cómo lo consiguen? Durante décadas, los científicos han estado estudiando cómo los hongos resisten a los compuestos diseñados para debilitarlos o matarlos. En el caso de las equinocandinas, C. auris suele utilizar tres estrategias: ocultarse, reconstruir y mutar.
El primer mecanismo consiste en envolverse en una biopelícula, es decir, en un camuflaje complejo de azúcares, proteínas, ADN y células que es impermeable a los medicamentos.
Estas coberturas son especialmente peligrosas cuando las células fúngicas crecen en equipos médicos como aireadores traqueales o catéteres, porque una vez liberadas de la biopelícula, las células que han adquirido la capacidad de resistir a los fármacos se vuelven más peligrosas para los pacientes medicados.
La segunda estrategia consiste en construir paredes celulares diferentes. Cuando las células fúngicas son tratadas con equinocandinas, dejan de producir betaglucanos y comienzan a fabricar más quitina. Las equinocandinas no pueden impedir la producción de quitina, por lo que el hongo puede reconstruir una nueva pared celular resistente y evitar así los daños. Aunque existen algunos medicamentos que pueden detener la fabricación de quitina, ninguno está aprobado actualmente para uso clínico.
La tercera estrategia es cambiar la estructura química de la enzima productora de betaglucanos para que las equinocandinas no puedan bloquearla. Estas mutaciones permiten que continúe la producción de esos polisacáridos incluso en presencia del fármaco. No es de extrañar que Candida auris utilice esa estrategia para resistir los medicamentos antimicóticos, ya que es muy eficaz para mantener vivas las células.
Nuevas tácticas del combate antifúngico
Los científicos se encuentran inmersos en la búsqueda de tácticas para combatir las infecciones fúngicas resistentes a las equinocandinas. El primer enfoque es encontrar nuevos medicamentos. Por ejemplo, hay dos fármacos en desarrollo, rezafungina e ibrexafungerp, que parecen capaces de detener la producción de betaglucanos incluso en hongos resistentes a las equinocandinas.
Una estrategia complementaria es probar la eficacia de una clase de enzimas llamadas glucosidasas. Algunas de estas proteínas destruyen activamente la pared celular fúngica, separando simultáneamente el betaglucano y la quitina, lo que podría ayudar a evitar que los hongos sobrevivan en los equipos de los hospitales.
El objetivo último de estas investigaciones es ofrecer terapias efectivas y prevenir la propagación de infecciones resistentes, una batalla contra los hongos patógenos que se está librando en los laboratorios y hospitales de todo el mundo. En definitiva, esperemos que algún día los médicos puedan decir a menudo a sus pacientes: “Sufre una infección por hongos, pero ahora tenemos un buen tratamiento”.
Por:
Manuel Peinado Lorca
Catedrático de Universidad. Director del Real Jardín Botánico de la Universidad de Alcalá, Universidad de Alcalá
José Miguel Sanz Anquela
Profesor honorífico. Departamento de Medicina y Especialidades Médicas, Universidad de Alcalá
Artículo publicado originalmente en The Conversation el 20 de junio de 2023

